Прочитав эту увлекательную статью о фаготерапии, я почувствовал себя одновременно заинтригованным и с осторожным оптимизмом. Как медицинский работник с многолетним опытом лечения инфекций, устойчивых к антибиотикам, я своими глазами видел ужасные последствия, к которым может привести такая резистентность. Потенциал фаговой терапии для борьбы с этими супербактериями, несомненно, впечатляет, но, как и любой новый медицинский подход, он сопряжен со своими проблемами и неопределенностями.
🚀 Хочешь улететь на Луну вместе с нами? Подписывайся на CryptoMoon! 💸 Новости крипты, аналитика и прогнозы, которые дадут твоему кошельку ракетный ускоритель! 📈 Нажмите здесь: 👇
CryptoMoon Telegram
В 1910 году франко-канадский микробиолог Феликс д’Эрелль, просматривая свой микроскоп, заметил в своих бактериальных образцах несколько необычных «прозрачных областей», которые, как позже выяснилось, были вирусами, питающимися бактериями. В последующие годы д’Эрель использовал эти вирусы, которые он называл бактериофагами, для лечения пациентов, страдающих дизентерией после Первой мировой войны.
Впоследствии д’Эрель и другие использовали эту фаговую терапию для лечения таких заболеваний, как бубонная чума и различные бактериальные инфекции. Однако, когда в 1940-х годах использование антибиотиков стало широко распространенным, этот метод был практически забыт.
В настоящее время, из-за того, что бактерии становятся все более устойчивыми к многочисленным антибиотикам, фаговая терапия вновь вызывает интерес исследователей – иногда с новым подходом. Вместо того, чтобы просто использовать фаги для непосредственной ликвидации бактерий, новая стратегия направлена на то, чтобы поставить бактерии в эволюционное затруднительное положение, в котором они не смогут уклоняться одновременно и от фагов, и от антибиотиков.
Предварительные исследования этой стратегии, известной как фаговое наведение, дали положительные результаты, однако до сих пор неясно, насколько широко она может быть применима в реальных сценариях.
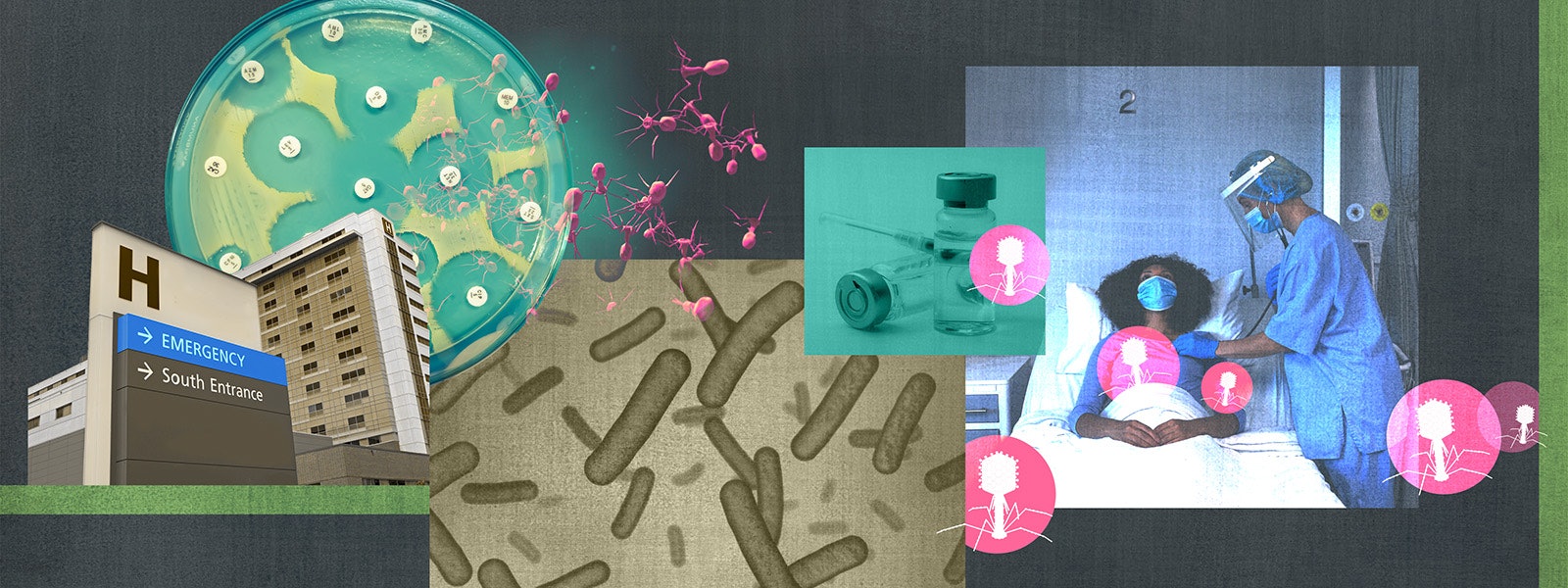
Конечно, существует необходимость найти новые способы реагирования на бактериальные инфекции. Более 70 процентов внутрибольничных бактериальных инфекций в США устойчивы как минимум к одному типу антибиотиков. Некоторые патогены, такие как Acinetobacter, Pseudomonas, Escherichia coli и Klebsiella, классифицируются Всемирной организацией здравоохранения как одни из самых серьезных угроз для здоровья человека. — устойчивы к нескольким антибиотикам. В 2019 году резистентность к антибактериальным препаратам была связана с 4,95 миллионами смертей во всем мире, что усиливает потребность в более эффективных вариантах лечения.
Одним из методов, с помощью которого бактерии могут развить устойчивость к антибиотикам, является использование внутри их мембран механизмов, выводящих вредные вещества из клетки. Изменяя эти «системы вытеснения», часто называемые «откачивающими насосами», бактерии могут распознавать и вытеснять антибиотик до того, как он станет токсичным, тем самым переживая его воздействие.
Интересно отметить, что некоторые вирусы, известные как фаги, по-видимому, используют одни и те же насосы оттока для проникновения в бактериальные клетки. Эти фаги, по-видимому, действуют, прикрепляя свои хвосты к белкам-насосам, подобно ключу, вставному в замок, а затем вводя внутрь свой генетический материал. Такое удачное совпадение событий побудило Пола Тернера, биолога-эволюциониста из Йельского университета, предложить потенциально эффективную стратегию лечения: назначение антибиотиков вместе с фагами может поставить бактерии перед дилеммой. Если они адаптируют свои откачивающие насосы для предотвращения прикрепления фагов, насосы перестанут вытеснять антибиотики, и устойчивость бактерий будет потеряна. С другой стороны, если они сохранят устойчивость к антибиотикам, фаги уничтожат их. Этот двойной подход обсуждался Тернером и его командой в выпуске Ежегодного обзора вирусологии за 2023 год.
Майкл Хохберг, биолог-эволюционист из Национального центра научных исследований Франции, объясняет, что результат, по сути, представляет собой двусторонний подход. Проще говоря, он описывает это как стратегию, которая пересекается или пересекается во многих местах. Этот метод потенциально может быть использован для предотвращения развития бактериальной резистентности путем воздействия на другие молекулярные компоненты, которые имеют двойную функцию, связанную с устойчивостью к вирусам и антибиотикам.
Тернер исследовал эту теорию на примере Pseudomonas aeruginosa с множественной лекарственной устойчивостью — опасной бактерии, часто встречающейся в медицинских учреждениях и способной вызывать тяжелые инфекции. Эта бактерия обладает четырьмя откачивающими насосами, которые способствуют устойчивости к антибиотикам. Тернер предположил, что если бы он смог обнаружить фаг, который использовал бы один из этих насосов в качестве точки входа, бактерия, скорее всего, отреагировала бы, изменив этот рецептор – по сути, блокируя фаг и препятствуя его способности выводить антибиотики.
Группа Тернера собрала 42 варианта фага из окрестностей, специально нацеленных на Pseudomonas aeruginosa. Среди них был идентифицирован особый штамм под названием OMKO1, прикрепленный к откачивающему насосу. Это делает ОМКО1 идеальным выбором для предстоящего эксперимента.
Впоследствии исследователи вырастили устойчивый к антибиотикам P. aeruginosa вместе с OMKO1 с целью побудить бактерию настроить свой эффлюксный насос, чтобы противостоять фагу. Впоследствии они подвергли эти устойчивые к фагам бактерии, а также их стандартные, уязвимые к фагам аналоги, четырем антибиотикам, к которым у бактерий развилась устойчивость: тетрациклину, эритромицину, ципрофлоксацину и цефтазидиму.
Согласно теории, бактерии, выработавшие устойчивость к фагу, оказались более уязвимыми к антибиотикам по сравнению с теми, которые ранее не подвергались воздействию фага. Это означает, что бактерии в борьбе с фагом, возможно, были вынуждены отказаться от устойчивости к антибиотикам.
Другие ученые продемонстрировали, что направляющие фаги могут повторно сенсибилизировать бактерии к антибиотикам, к которым они приобрели устойчивость, включая колистин. Исследование, проведенное международной исследовательской группой, показало, что особый фаг, известный как Phab24, может быть использован для того, чтобы сделать Acinetobacter baumannii, бактерию, ответственную за тяжелые заболевания, снова чувствительной к колистину.
В ходе последующего исследования исследователи из Университета Монаша в Австралии собрали инфекционные бактерии у пациентов. Они обнаружили, что определенные фаги, такие как штаммы ΦFG02 и ΦCO01, естественным образом присутствовали в некоторых образцах. Разоблачение А. baumannii к этим фагам приводило к дезактивации гена, имеющего решающее значение для производства защитного внешнего слоя, или капсулы, бактерии. Этот слой позволяет проникать фагам, но также помогает A. baumannii образуют биопленки, устойчивые к антибиотикам. Устранив слой, они создали A. baumannii чувствителен к нескольким антибиотикам, к которым ранее был невосприимчив.
В третьем исследовании, проведенном исследователями из Ливерпульского университета, они обнаружили, что штамм бактерий, известный как P. aeruginosa, устойчивый ко всем доступным антибиотикам, стал чувствительным к двум ранее неэффективным антибиотикам при воздействии фагов.
Как геймер, погружающийся в мир передовых медицинских исследований, я слежу за работой Бенджамина Чана, микробиолога из Йельского университета, который сотрудничает с Тернером. Его команда использовала увлекательную технику, называемую управлением фагами, во многих случаях персонализированной терапии в клинических условиях. Предварительные результаты, большая часть которых остается неопубликованной, на данный момент оказались многообещающими.
Дьявол в деталях
По мнению молекулярного биолога Грэма Хэтфулла из Питтсбургского университета, фаговая терапия может быть неэффективной для всех устойчивых к антибиотикам бактерий из-за того, что фаги узкоспециализированы по отношению к своему конкретному хозяину. Поскольку у большинства фагов мишени их связывания на поверхности бактериальных клеток остаются неизвестными. Для того чтобы фаговая терапия успешно справлялась с устойчивостью к антибиотикам, фаг должен связаться с молекулой, вызывающей устойчивость. Однако неизвестно, как часто случается такое удачное совпадение.
По словам Джейсона Гилла, эксперта по биологии бактериофагов из Техасского университета A&M, может быть сложно предсказать, будет ли фаг способствовать повышению чувствительности к антибиотикам. В результате важно каждый раз постоянно искать подходящий вирус.
Гилл лично был свидетелем тонкостей этого метода, будучи членом группы исследователей и медицинских работников, которые использовали фаги для лечения пациента, страдающего трудноизлечимым А. baumannii вследствие множественной лекарственной устойчивости. Примечательно, что менее чем через четыре дня после того, как команда ввела фаги внутривенно и местно, пациент вышел из комы и начал положительно реагировать на миноциклин, антибиотик, который ранее не показывал никакого эффекта – поистине выдающееся достижение.
С энтузиазмом исследуя увлекательный мир бактерий, я был заинтригован, когда Гилл предпринял аналогичный эксперимент на клеточных культурах с A. baumannii. Интересно, что эти бактерии развили устойчивость к фагам, но сохранили устойчивость к миноциклину. По словам Гилла, «связь между устойчивостью к фагам и чувствительностью к антибиотикам может не быть универсальной». Это говорит о том, что, хотя манипуляции с фагами потенциально могут быть эффективными, их успех может зависеть от конкретного бактериального штамма, фага и антибиотика.
Будучи геймером, я узнал о потенциальной проблеме с фагами — они могут быть слишком эффективными. Если эти бактериальные убийцы уничтожат огромное количество бактерий и слишком быстро сбросят их остатки в кровоток, это может вызвать септический шок у пациентов. Исследователи все еще пытаются выяснить, как решить эту проблему.
Одна из проблем заключается в том, что врачи могут не иметь такого точного контроля над бактериофагами (фагами) по сравнению с антибиотиками. Как объясняет Хохберг: «Фаги могут меняться, они могут адаптироваться, они несут генетический код». Соображения безопасности, отмечает он, являются одной из причин, по которой сдерживается регулярное использование фаговой терапии в таких странах, как Соединенные Штаты, и ограничивается ее конкретными ситуациями, такими как случай Тернера и Чана.
В 1940-х годах фаговая терапия могла считаться слишком продвинутой, и даже сегодня исследователи изо всех сил пытаются найти эффективные способы ее применения. По словам Тернера, сейчас необходимы хорошо структурированные исследования, которые помогут нам понять, как оптимизировать его использование.
Эта статья первоначально появилась в журнале Knowable Magazine, независимом журналистском издании Annual Reviews. Подпишитесь на рассылку.
Смотрите также
- Как пройти самый сумасшедший квест Avowed, «Курьер Пустоши»
- Кто такой муж Колмана Доминго Рауль Доминго? Все о его жизни
- «Капитан Америка: О дивный новый мир» наконец-то отвечает на самый большой вопрос Вечных«
- Слава «Звездного пути» Роберт Пикардо поджарил Илона Маска после его твита о Звездном Флоте; Читать подробности
- Атлас и 3 новых боевика, которые можно будет посмотреть на Netflix весной 2024 года
- Кто такая София Фальконе из «Пингвина»? Объяснение ее истории в комиксах DC
- Сколько детей у Джастина Бальдони? Все, что мы знаем об этом, заканчивается на нас, семье звезды
- Sunray: Павший солдат – ОБЗОР
- Самая недооцененная триллер-франшиза Netflix возвращается к основам
- Портативное устройство Anbernic RG40XX H может играть в игры PSP, Nintendo DS и Dreamcast
2024-09-19 18:29